Kostenloser Versand ab 100 €
- Mundschutz
- OP-Masken
- FFP2-Masken
- FFP3-Masken
- Kinder-Masken
- Gesichtsschutz
- Masken made in Germany
- Corona-Schnelltests
- Selbsttests / Laientests
- Antigentests
- Antikörpertests
- Lolli-Tests
- Schnelltests für die Nase
- Schnelltests für Nase und Rachen
- Schnelltests für den Rachen
- Spucktests
- Drogentest
- Viren-Barriereartikel
- Desinfektionsmittel
- Desinfektionstücher
- Hand-Desinfektionsmittel
- Flächendesinfektionsmittel
- Schutzkleidung
- Einweghandschuhe
- Schutzanzüge
- Schutzkittel
- Schutzbrillen
- Überschuhe
- Überärmel
- Luftreiniger/Luftfilter
- Sonstiges
- Marken
- Marken A-Z
- Topmarken Alle Marken im Überblick
Suchvorschläge
Keine Suchergebnisse gefunden.
Artikel
Keine Suchergebnisse gefunden.
Kategorien
Keine Suchergebnisse gefunden.
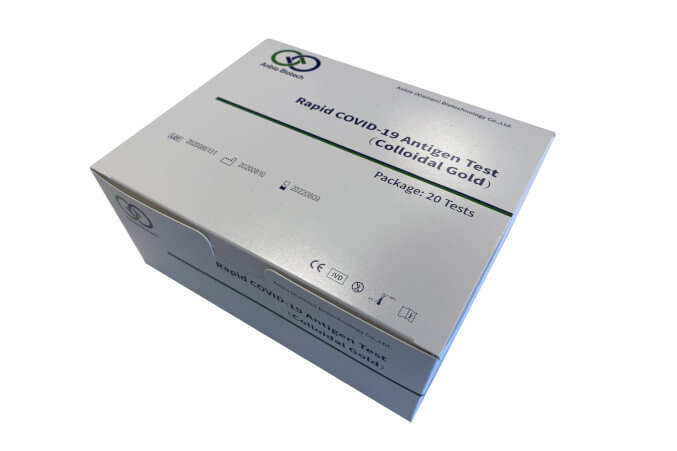
Anbio Biotech Antigen Schnelltest 3in1 - 20 Stück
- Einfache 3-in-1-Probenentnahme mit Nasen-, Rachenabstrich oder Lutschtest
- Geeignet bei Verdacht auf COVID-19-Infektion
- Klinische Studie bestätigt Sensitivität von 99,18% und Spezifität von 100%
- Keine Instrumentierung erforderlich, ideal für groß angelegte Tests
- Nur für medizinisches oder geschultes Personal bestimmt
- Artikelnummer: 255
- Hersteller: Anbio-Biotech

Sie haben Fragen?
Unsere ausgebildeten Ansprechpartner beraten Sie und helfen Ihnen gern weiter.
20x Anbio Corona Antigen 3in1 Schnelltest AT 195/21
Anbio Biotech Antigen Schnelltest 3in1 ist ein zuverlässiges Diagnose-Tool zur qualitativen Bestimmung von Nucleocapsid-Antigenen aus SARS-CoV-2 in menschlichen Nasenabstrichen, Rachenabstrichen oder Speichelproben. Der Test eignet sich für Personen, bei denen der Verdacht auf eine COVID-19-Infektion besteht.
Die 3-in-1-Probenentnahme erfolgt entweder mit einem vorderen Nasen- bzw. Rachenabstrich oder als Lutschtest und ist einfach zu handhaben. Der Test erfordert nur 3 Arbeitsschritte und die Lösungen sind einzeln abgefüllt und gebrauchsfertig. Eine Instrumentierung ist nicht erforderlich, was den Test kostengünstig und ideal für groß angelegte Tests macht.
Die klinische Leistung des Tests wurde durch Testen von 1096 positiven und 793 negativen Proben auf SARS-CoV-2-Antigen mit einer Sensitivität von 99,18% (95% CI: 98,45% - 99,62%) und einer Spezifität von 100% (95% CI: 99,54% - 100%) bestätigt. Der Test liefert innerhalb von 15 Minuten ein schnelles Ergebnis.
Der ANBIO 3in1 Rapid COVID-19-Antigen-Test ist ausschließlich für medizinisches oder geschultes Personal bestimmt. Jede Packung enthält 20 Testkarten, 20 Extraktionsrohre mit Lösung, 20 Tupfer und eine Packungsbeilage mit Anweisungen zur Verwendung des Tests. Der Test ist durch die BfArM Test-ID AT 195/21 zugelassen und bietet eine zuverlässige und schnelle Möglichkeit zur Diagnose von COVID-19-Infektionen.
Produkteigenschaften:
- 3 in 1 Probenentnahme mit vorderem Nasen- bzw. Rachenabstrich oder als Lutschtest.
- Einfachste Handhabung mit nur 3 Arbeitsschritten und einzeln abgefüllten, gebrauchsfertigen Lösungen.
- Hohe Leistung durch klinische Studie nachgewiesen.
- Schneller Nachweis von SARS-COV-2-Nucleocapsid-Antigen in 15 Minuten.
- Keine Instrumentierung erforderlich.
- Kostengünstige Lösung für groß angelegte Tests.
- Nur zur Verwendung durch medizinisches oder geschultes Personal
- Die klinische Leistung des COVID-19-Antigen-Schnelltests (kolloidales Gold) wurde durch Testen von 1096 positiven und 793 negativen Proben auf SARS-CoV-2-Antigen mit einer Sensitivität von 99,18% (95% CI: 98,45% - 99,62%) und einer Spezifität von 100% (95% CI: 99,54% - 100%) bestimmt. Klinische Proben wurden mit einer RT-PCR-Referenzmethode als positiv oder negativ bestimmt.
- BfArM Test-ID AT 195/21
Lieferumfang:
- 20x Testkarte
- 20x Extraktionsrohr mit Lösung
- 20x Tupfer
- 1x Packungsbeilage
- Artikelnummer: 255
- Gewicht: 280g
- Inhalt: 20 Stück
- Maße: 180x75x140mm
- Hersteller: Anbio-Biotech
- Zustand: Neu
Andere Kunden kauften auch
 Auf die Merkliste
Erkennt Omikron
(0)
Acon
Acon FlowFlex SARS CoV-2 Antigen Schnelltest - 25 Stück 29,99 €
Auf die Merkliste
Erkennt Omikron
(0)
Acon
Acon FlowFlex SARS CoV-2 Antigen Schnelltest - 25 Stück 29,99 € 39,90 €-24% 25,20 €33,53 €-24% 1,20 € / Stück 1,01 € / Stück Lieferzeit auf Anfrage Auf die Merkliste Auf die Merkliste
Erkennt Omikron
(0)
Hotgen
Hotgen Novel SARS-CoV-2 Antigentest (Nasen- oder Rachenabstrich) - 40 Stück 21,99 €
Auf die Merkliste
Erkennt Omikron
(0)
Hotgen
Hotgen Novel SARS-CoV-2 Antigentest (Nasen- oder Rachenabstrich) - 40 Stück 21,99 € 79,90 €-72% 18,48 €67,14 €-72% 0,55 € / Stück 0,46 € / Stück Lieferzeit auf Anfrage Auf die Merkliste Auf die Merkliste
Erkennt Omikron
(2)
Clungene
Clungene® COVID-19 Antigen Nasen/Rachen Schnelltest - 25 Stück 23,99 €
Auf die Merkliste
Erkennt Omikron
(2)
Clungene
Clungene® COVID-19 Antigen Nasen/Rachen Schnelltest - 25 Stück 23,99 € 34,90 €-31% 20,16 €29,33 €-31% 0,96 € / Stück 0,81 € / Stück Sofort versandfertig, Lieferzeit 48h* Auf die Merkliste
Das könnte Sie auch interessieren
5
4
3
2
1
Rezensionen werden geladen...
Rezension löschen
Wir verwenden Cookies und ähnliche Technologien auf unserer Website und verarbeiten personenbezogene Daten von Besucher:innen unserer Webseite (z.B. IP-Adresse), um z.B. Inhalte und Anzeigen zu personalisieren, Medien von Drittanbietern einzubinden oder Zugriffe auf unsere Website zu analysieren. Die Datenverarbeitung erfolgt erst durch gesetzte Cookies. Wir teilen diese Daten mit Dritten, die wir in den Einstellungen benennen.
Die Datenverarbeitung kann mit Einwilligung oder aufgrund eines berechtigten Interesses erfolgen. Die Zustimmung kann erteilt oder abgelehnt werden. Es besteht das Recht, nicht einzuwilligen und die Einwilligung zu einem späteren Zeitpunkt zu ändern oder zu widerrufen. Weitere Informationen zur Verwendung personenbezogener Daten und den Diensten erklären wir in unserer Datenschutzerklärung.
- Deutschland 5,80€
- Europa ab 15,99€
- Schweiz ab 26,99€
alle Preise inkl. MwSt.
Für Kunden aus der Schweiz:
Für Lieferungen in die Schweiz empfehlen wir Ihnen den Service von MeinEinkauf.ch zu nutzen. Alle Zollformalitäten und die Lieferung zu Ihrer Haustür übernimmt dann gegen eine geringe Gebühr MeinEinkauf.ch. Registrieren Sie sich hierzu am besten noch vor Ihrer Anmeldung bei MeinEinkauf.ch.
test
DHL Paket
| Deutschland | Pauschal 5,80€ | |||
| bis 5kg | bis 10kg | bis 20kg | bis 31,5kg | |
| 15,99€ | 20,99€ | 31,18€ | 43,86€ | |
| 26,90€ | 34,99€ | 48,99€ | 55,99€ | |
| 29,99€ | 37,99€ | 52,99€ | 60,99€ |
alle Preise inkl. MwSt.
DHL Express Paket
| Deutschland | Pauschal 23,99€ | |||
| bis 5kg | bis 10kg | bis 20kg | bis 31,5kg | |
| 19,19€ | 25,19€ | 37,39€ | 52,59€ | |
| 34,90€ | 44,90€ | 59,90€ | 69,90€ | |
| 39,90€ | 49,90€ | 54,90€ | 74,90€ | |
| 39,90€ | 49,90€ | 69,90€ | 79,90€ | |
| 49,90€ | 69,90€ | 99,90€ | 129,90€ | |
| 49,90€ | 54,90€ | 89,90€ | 124,90€ | |
| 54,90€ | 74,90€ | 119,90€ | 159,90€ | |
| 64,90€ | 84,90€ | 129,90€ | 169,90€ |
alle Preise inkl. MwSt.
test